Données relatives à l’intensité des démangeaisons et à la QdV liée aux démangeaisons sous PrKORSUVAMD
PrKORSUVAMD a réduit l’intensité des démangeaisons (amélioration d’au moins 3 points du score WI-NRS) entre le début de l’étude et la semaine 12 comparativement au placebo1†
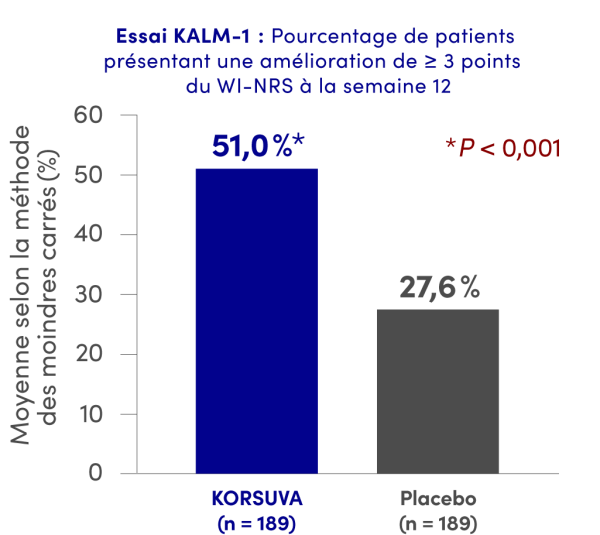
Nombre de patients présentant une amélioration ≥ 3 points (NRS) : 157 (oui = 82, non = 75; donnée manquante, n = 32) et 165 (oui = 51, non = 114; donnée manquante, n = 24) pour KORSUVA et le placebo, respectivement. Les nombres ont été calculés selon le nombre de patients pour lesquels toutes les valeurs étaient connues.
Le pourcentage estimé et la valeur P ont été calculés à l’aide d’un modèle de régression logistique avec des termes pour le groupe de traitement, le score initial sur l’échelle d’évaluation numérique de l’intensité des pires démangeaisons (WI-NRS), l’utilisation d’un médicament antidémangeaison pendant la semaine précédant la répartition aléatoire et la présence de maladies particulières. Les valeurs manquantes ont été imputées en fonction des caractéristiques des patients répartis aléatoirement au groupe de traitement, en supposant qu’elles étaient manquantes à la répartition pour les patients de l’analyse intérimaire et pour ceux de l’analyse post-intérimaire, séparément.
Adapté de la monographie de produit1.
Résultats mis en évidence à la semaine 12 pour la QdV liée aux démangeaisons (scores sur les échelles Skindex-10 et 5-D) (paramètres secondaires)1†
Dans le cadre de l’essai KALM-2, les scores sur les échelles Skindex-10 et 5-D n’étaient pas statistiquement significatifs.
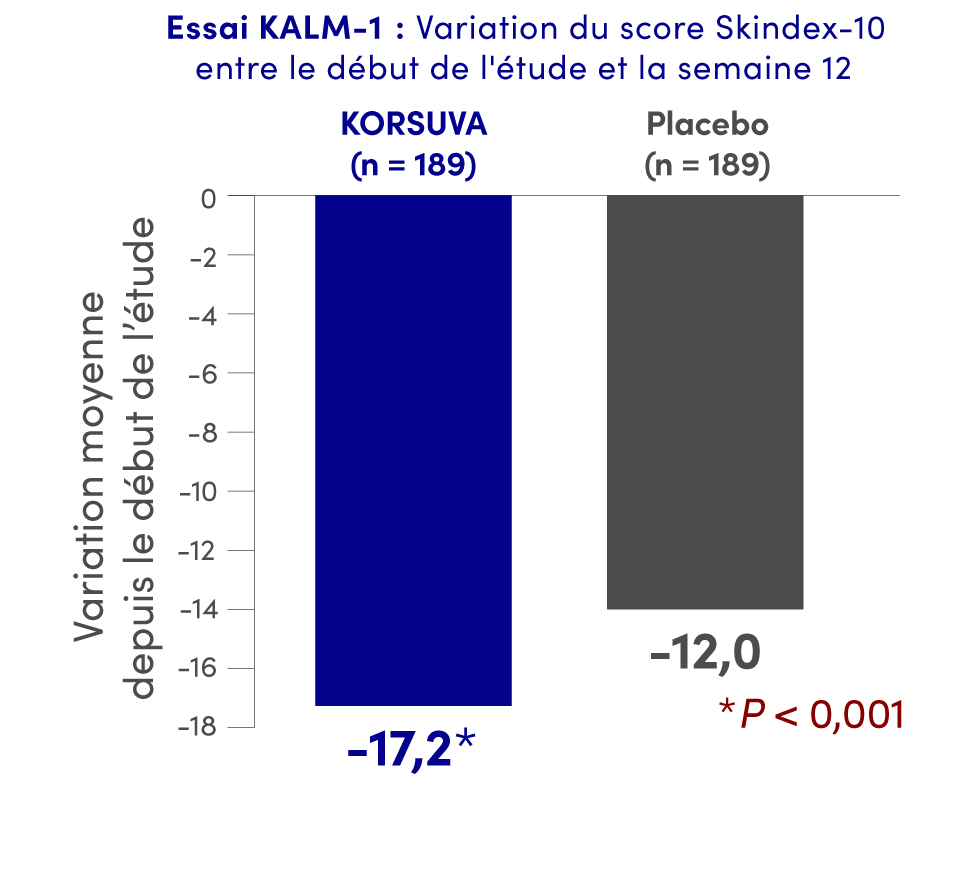
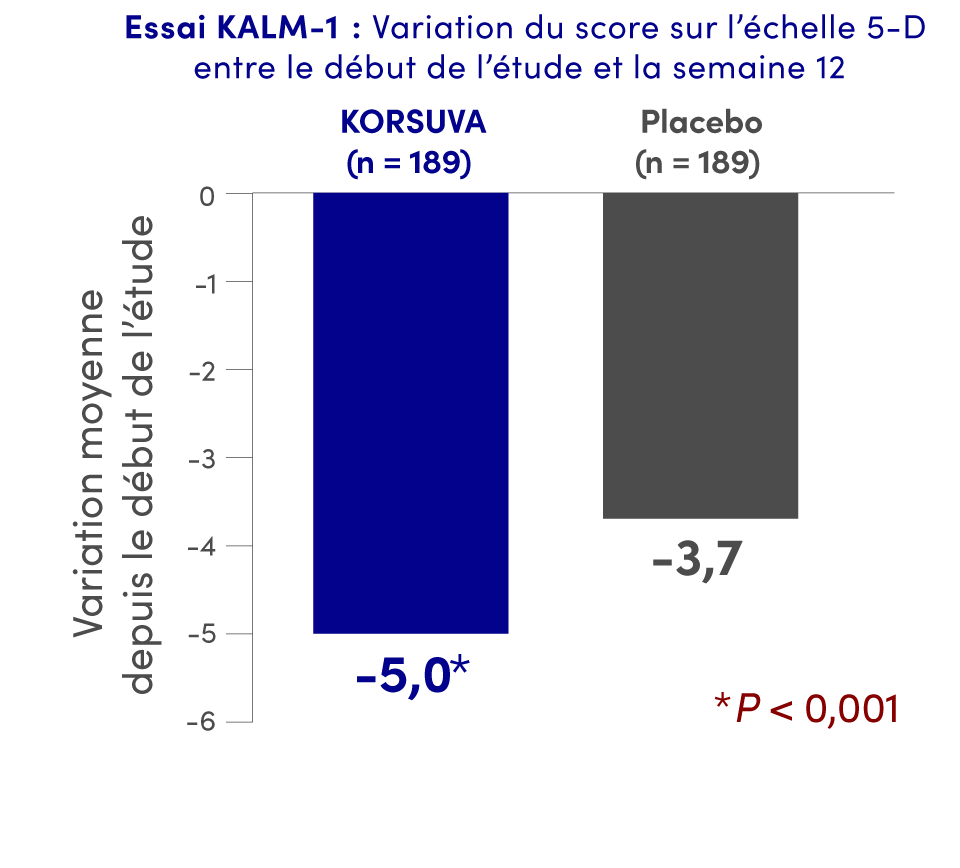
Essais KALM-1 et KALM-2 : Deux essais multicentriques, à répartition aléatoire, à double insu et contrôlés par placebo auxquels ont participé 851 sujets âgés de 18 ans ou plus traités par hémodialyse qui présentaient un prurit modéré ou grave. L’essai KALM-1 était mené aux États-Unis, tandis que KALM-2 était mené à l’échelle mondiale. Les sujets ont reçu un placebo ou KORSUVA à une dose de 0,5 mcg/kg par voie i.v. trois fois par semaine après l’hémodialyse pendant 12 semaines. Les patients étaient autorisés à continuer d’utiliser des médicaments antiprurigineux (p. ex., des antihistaminiques, des corticostéroïdes, des gabapentinoïdes). Les deux essais comprenaient une phase à double insu et une phase ouverte (52 semaines).
